مول و مولاریته

"مول" یک واحد اندازهگیری است که در علم شیمی برای شمردن تعداد ذرات موجود به کار میرود.
اندازهگیری واحدی مانند مول به شمردن تعداد 12 عدد کیک شبیه است! البته کیک میتواند یکی یکی شمرده شود اما اگر تعداد کیکها زیاد است، بهتر است دوجین دوجین آنها را بشماریم.
اتمها نیز میتوانند به صورت نظری یکی یکی شمرده شوند. اما حتی یک بلور کوچک الماس شامل تعداد اتم کربنی بالای 100,000,000,000,000,000 است!
بنابراین چون تعداد اتمها زیاد است باید از یک واحد اندازهگیری بهتری استفاده کنیم.
تعریف مول:
به طور اختیاری، دوجین به معنای 12 تا است اما تعریف مول بر اساس نتایج تجربی به صورت زیر است:
مول، تعداد ایزوتوپهای موجود در 12 g ایزوتوپ کربن- 12 است.
این تعداد تقریباً با 6.0221367 * 1023 است. این مقدار، عدد آووگادرو یا ثابت آووگادرو (L) است و به افتخار دانشمند ایتالیایی آمادئو آووگادرو چنین نامیده شده است.
 |
برخلاف دوجین، مول یک عدد معمولی نیست. زیرا همچنان از نظر تجربی، شمردن تک تک اتمها امکان ندارد. دستیابی به عدد آووگادرویی صحیحتر هنوز هم مورد توجه برخی دانشمندان است.
در سطح رسمی، معمولاً عدد آووگادرو را به صورت زیر بیان میکنند:
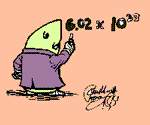

شمردن اتمها به وسیلهی وزن کردن:
بر اساس تعریف مول و نتایج تجربی:
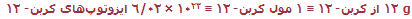
(نماد ≡ به معنای هم ارزی است). به دلیل اینکه تمام جرمهای ایزوتوپی بر اساس مقیاس کربن- 12 هستند، جرم 1 مول از ایزوتوپهای دیگر نیز میتواند معین شود.
مثال:
جرم یک ایزوتوپ Mg - 12 دو برابر جرم ایزوتوپ C - 12 است؛ یعنی:

با وزن کردن 24 g از Mg-24 ، میتوان به 6.02 * 1023 ایزوتوپ Mg-24 رسید. همچنین برای محاسبه 1.00* 1020 ایزوتوپ Mg-24 باید :
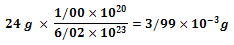
از Mg-24 را وزن کرد.
جرم 1 مول از یک مادهی خاص، جرم مولی آن نامیده میشود.
جرم مولی یک ایزوتوپ به طور عددی مشابه جرم نسبی ایزوتوپ است. اما جرم مولی دارای واحد gmol-1 است در حالی که جرم ایزوتوپی واحدی ندارد.
یعنی:
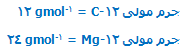
این کار ،امکان شمردن اتمها با وزن کردن را به وجود میآورد؛ پس دلیل تعیین عدد مولی به این طریق معلوم میشود.
به طور مشابه، تعداد اتمها میتواند با استفاده از جرم اتمی نسبی محاسبه شود؛ یعنی:
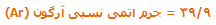

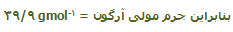

محاسبهی واحد فرمولی با وزن کردن:
با ذکر مثال میتوان این مطلب را بهتر متوجه شد:
1 واحد فرمولی H2O از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است؛ یک مول مولکول H2O از دو مول اتم هیدروژن و ا مول اتم اکسیژن تشکیل شده است.
جرم 1 مول H2O:
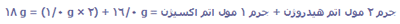
جرم فرمولی و جرم مولکولی:
جرم فرمولی به صورت جمع جرم اتمی نسبی موجود در یک فرمول، تعیین میشود؛ یعنی:
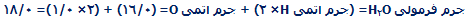
جرم مولکولی، جمع جرم اتمی نسبی موجود در یک فرمول مولکولی است.
مثال:
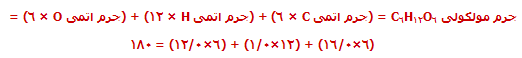
جرم مولکولی به جرم فرمولی شبیه است اما فقط به ترکیب مولکولی محدود شده است.
جرم مولی مواد مختلف:
گفتیم جرم 1 مول از یک مادهی خاص، جرم مولی آن ماده نامیده میشود. به عنوان مثال:
جرم مولی C-12 = 12 gmol-1
جرم مولی سدیم کلراید (NaCl) = (23.0+35.5) gmol-1 = 58.5 gmol-1
جرم مولی از نظر عددی مشابه جرم فرمولی است اما جرم مولی، گرم واحد در هر مول دارد (gmol-1).
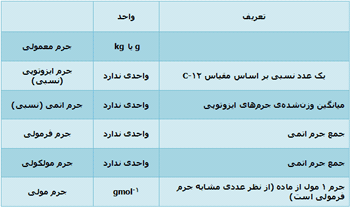
مقایسهی جرمهای مختلف:
مول و مولاریته

"مول" یک واحد اندازهگیری است که در علم شیمی برای شمردن تعداد ذرات موجود به کار میرود.
اندازهگیری واحدی مانند مول به شمردن تعداد 12 عدد کیک شبیه است! البته کیک میتواند یکی یکی شمرده شود اما اگر تعداد کیکها زیاد است، بهتر است دوجین دوجین آنها را بشماریم.
اتمها نیز میتوانند به صورت نظری یکی یکی شمرده شوند. اما حتی یک بلور کوچک الماس شامل تعداد اتم کربنی بالای 100,000,000,000,000,000 است!
بنابراین چون تعداد اتمها زیاد است باید از یک واحد اندازهگیری بهتری استفاده کنیم.
تعریف مول:
به طور اختیاری، دوجین به معنای 12 تا است اما تعریف مول بر اساس نتایج تجربی به صورت زیر است:
مول، تعداد ایزوتوپهای موجود در 12 g ایزوتوپ کربن- 12 است.
این تعداد تقریباً با 6.0221367 * 1023 است. این مقدار، عدد آووگادرو یا ثابت آووگادرو (L) است و به افتخار دانشمند ایتالیایی آمادئو آووگادرو چنین نامیده شده است.
 |
برخلاف دوجین، مول یک عدد معمولی نیست. زیرا همچنان از نظر تجربی، شمردن تک تک اتمها امکان ندارد. دستیابی به عدد آووگادرویی صحیحتر هنوز هم مورد توجه برخی دانشمندان است.
در سطح رسمی، معمولاً عدد آووگادرو را به صورت زیر بیان میکنند:

شمردن اتمها به وسیلهی وزن کردن:
بر اساس تعریف مول و نتایج تجربی:
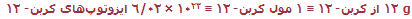
(نماد ≡ به معنای هم ارزی است). به دلیل اینکه تمام جرمهای ایزوتوپی بر اساس مقیاس کربن- 12 هستند، جرم 1 مول از ایزوتوپهای دیگر نیز میتواند معین شود.
مثال:
جرم یک ایزوتوپ Mg - 12 دو برابر جرم ایزوتوپ C - 12 است؛ یعنی:

با وزن کردن 24 g از Mg-24 ، میتوان به 6.02 * 1023 ایزوتوپ Mg-24 رسید. همچنین برای محاسبه 1.00* 1020 ایزوتوپ Mg-24 باید :
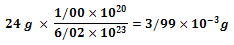
از Mg-24 را وزن کرد.
جرم 1 مول از یک مادهی خاص، جرم مولی آن نامیده میشود.
جرم مولی یک ایزوتوپ به طور عددی مشابه جرم نسبی ایزوتوپ است. اما جرم مولی دارای واحد gmol-1 است در حالی که جرم ایزوتوپی واحدی ندارد.
یعنی:
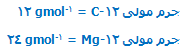
این کار ،امکان شمردن اتمها با وزن کردن را به وجود میآورد؛ پس دلیل تعیین عدد مولی به این طریق معلوم میشود.
به طور مشابه، تعداد اتمها میتواند با استفاده از جرم اتمی نسبی محاسبه شود؛ یعنی:
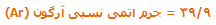

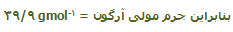

محاسبهی واحد فرمولی با وزن کردن:
با ذکر مثال میتوان این مطلب را بهتر متوجه شد:
1 واحد فرمولی H2O از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است؛ یک مول مولکول H2O از دو مول اتم هیدروژن و ا مول اتم اکسیژن تشکیل شده است.
جرم 1 مول H2O:
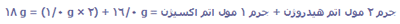
جرم فرمولی و جرم مولکولی:
جرم فرمولی به صورت جمع جرم اتمی نسبی موجود در یک فرمول، تعیین میشود؛ یعنی:
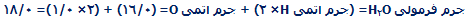
جرم مولکولی، جمع جرم اتمی نسبی موجود در یک فرمول مولکولی است.
مثال:
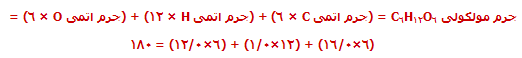
جرم مولکولی به جرم فرمولی شبیه است اما فقط به ترکیب مولکولی محدود شده است.
جرم مولی مواد مختلف:
گفتیم جرم 1 مول از یک مادهی خاص، جرم مولی آن ماده نامیده میشود. به عنوان مثال:
جرم مولی C-12 = 12 gmol-1
جرم مولی سدیم کلراید (NaCl) = (23.0+35.5) gmol-1 = 58.5 gmol-1
جرم مولی از نظر عددی مشابه جرم فرمولی است اما جرم مولی، گرم واحد در هر مول دارد (gmol-1).
مقایسهی جرمهای مختلف:
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

